原薬形態(solid form)のスクリーニングのコツ
2020.07.03
創薬プロセスの最終段階では、候補化合物の原薬形態を絞り込むが必要があります。その際に、発生する主な問題点に関して、我々スペラファーマがどのように対応しているか、そのコツをお伝えします。
1. はじめに
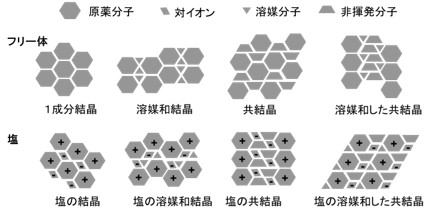
医薬品の原薬形態(solid form)の候補は多様であり、Figure 1に示されるようにフリー体、塩、および共結晶、さらにはそれぞれに対して結晶多形が存在する可能性がありますが、医薬品開発で候補化合物が絞られる段階において、これらの中から実際に開発する原薬形態(solid form)を選定する必要があります。一般には、原薬形態のスクリーニング(solid form screening)と呼ばれますが、個別には目的に応じて塩スクリーニング、共結晶スクリーニング、結晶多形スクリーニングと呼ばれる作業が実施されます。これらのスクリーニングには、多くの場合にhigh-throughput (HT) screening systemが適用されています。
![]()
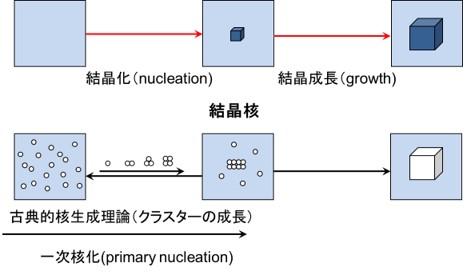
このHT screening systemの中でも、中核をなすのがHT crystallization 技術であり、well-plateを用いて様々な条件(数百種類以上)での結晶化が試みられます。HT crystallizationにおける結晶の取得にあたっては、結晶核化(nucleation)と結晶成長(growth)の二つの速度過程を考慮する必要があり、基本的には、結晶核化は一次核化(primary nucleation)の速度過程と考えられます(Figure 2)。

2. 結晶化時に発生する主なトラブル
新規化合物のHT screeningを実施する際には、この世で初めての結晶化であることを考慮しておくべきです。初めてのprimary nucleationを経た結晶にありがちなトラブルとしては、以下の3つがあります。
(1)結晶化しやすい化合物の場合、複数結晶形の混在
(2)結晶化しにくい化合物の場合、結晶化度が低い
(3)全く結晶化しない
これらケースについての弊社の対応例を紹介します。
3. トラブル対応 ケース(1)(2)
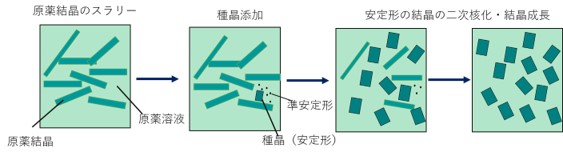
弊社では、(1)複数の結晶形の混在を避ける、(2)結晶化度を向上させることを目的として、HT crystallizationで得られた結晶を種晶として添加して、種晶から引き起こされる二次核(secondary nucleation) を発生させることを利用したcompetitive slurry conversion法を実施し、これによって溶液媒介転移を経て一つの結晶形に転移させ、かつ結晶化度の高い結晶が得られるような晶析実験を行っています(Figure 3, 4)。

![]()
![]()
次に、ここで得られたそれぞれの結晶を分析しキャラクタリゼーションして、原薬のsolid formとしての物性面を評価するようにしています。
しかし、中には種晶が取得できたものの、数十~数百mgスケールでの晶析実験においては、種晶としてうまく機能せずに目的とする量・品質(結晶化度)の結晶を得ることが容易ではない難結晶性化合物のケースもあります。
難結晶性化合物は、室温付近では粘性の高いオイルや飴状になりやすい場合が多く、種晶を添加しても二次核(secondary nucleation)や結晶成長が遅いことにより晶析が阻害されていることが考えられます。
このような難結晶性化合物の晶析には室温より少し高い温度にすることによって、粘性を下げて二次核(secondary nucleation)や結晶成長を促進させるような対処をとっています。また、冷却晶析において室温付近に下げる場合でも冷却速度を著しく遅くすることによって、結晶の成長速度を落とさないようにします。さらに、1回の冷却晶析で結晶の取得量が十分ではない場合には、加熱・冷却を繰り返すいわゆるtemperature swing crystallizationを実施する場合もあります。
4. トラブル対応 ケース(3)
原薬形態を検討する際に、化合物が全く結晶化しない場合もあります。結晶化しない化合物については、一次核化(primary nucleation)が起こりにくいと考えられます。これは本来、一次核化(primary nucleation)がrare-event processと称される頻度の低い確率論的現象であり、通常の化学反応速度でみられる速度過程と大きく異なっていることが原因と推定しています。つまり、一次核化(primary nucleation)の頻度が高い場合は、確率論的側面が隠れて通常の速度論のような取り扱いもできますが、一次核化(primary nucleation)の頻度が低いと確率論的側面が強く現れ、一次核化(primary nucleation)を促進することは非常に困難となります。
弊社では、結晶化の手法として冷却法、蒸発法、貧溶媒法、超音波照射法を試します。その際に、一次核化(primary nucleation)が起こりにくい化合物に対して効果的なのは、以下の2点と認識しています。
①使用する溶媒の種類に多様性を持たせること、
②単一溶媒条件だけでなく混合溶媒(その組成も含めて)としての多くの組み合わせを適用することよって、できる限り多様な条件を創出すること
さらに、一度の結晶化のトライで諦めることなく、結晶化の操作を繰り返すことによって結晶化に至る事例もあります。
5. 事例紹介
HT crystallizationの対象は原薬だけでなく、合成工程の中間体や、不斉合成工程で用いるジアステレオマー塩の場合もあり、対象化合物をまず結晶化させることが必須となります。ここでは、合成工程を構築する上で、中間体の結晶化が精製プロセスの鍵となるにもかかわらず、以前は結晶化ができなかった化合物をHT crystallizationを実施して結晶化させることができた事例を示します。
Well-plateの大部分がアモルファスでしたが、数検体に偏光顕微鏡のクロスニコル観察で、わずかに干渉色が認められたものがありました(Figure 5)。HT crystallizationにおいて多様性を上げた溶媒条件で結晶化を試み、偏光顕微鏡での観察を丹念に行うことによって、粉末X線回折(PXRD)だけではハローパターンとなって見逃す可能性のある結晶化を発見した例です。ここで得られた僅かな結晶を種晶として、competitive slurry conversion法を経て晶析プロセスを構築することになります。

![]()
晶析実験が実施可能となっても結晶を単離する際にトラブルが発生する場合もあります。著しい例では、晶析スラリーを偏光顕微鏡下で観察したところ、溶媒の揮発に伴って数分間で結晶性を喪失してアモルファス化したことがあります。弊社ではこれを避けるために、ろ過の際からバルブ付きのろ過装置(Figure 6)を用いて溶媒雰囲気下で実施し、そのままろ過装置内で結晶を保存することもあります。

![]()
6. 終わりに
以上のように、原薬のsolid formのスクリーニングにおいては、選定(screening)というプロセスよりも、結晶化(primary nucleation)のプロセスが重要となる傾向にあります。弊社では、96 well-plateタイプの装置を用いたprimary nucleationの実験(HT crystallization)と、ここで得られた結晶を種晶として用いた種晶添加competitive slurry conversion法による晶析実験と分離して実施する戦略をとっています。
弊社ではスクリーニングの効率のさらなる向上や、難結晶性化合物、物性の良くない化合物、結晶化しない化合物のように高難度の課題に対しても、お客様により良いソリューションを提供できるように、改善を続けています。
ご質問などございましたら、以下のボタンよりご連絡ください。
お問い合わせpage top